
Лекарственный суверенитет: как его добиться?
За последние годы российская фарминдустрия, пройдя через ряд потрясений, сумела доказать, что в сложной ситуации готова оперативно закрыть потребности нашей страны в лекарственном обеспечении. Так, Россия была первой страной, разработавшей эффективную вакцину от COVID-19. Однако разработка и производство инновационных препаратов в целом ведутся недостаточно интенсивно. Это приводит к тому, что наиболее современное лечение становится доступно пациентам в России на несколько лет позже, чем в других странах мира. А уже в ближайшем будущем она может стать недоступна вообще, так как иностранные фармкомпании отказались от проведения клинических испытаний в нашей стране и вывода на российский рынок инновационных препаратов.
Что нужно для того, чтобы добиться лекарственного суверенитета?
1
Создаются ли в России
оригинальные лекарства?
Если анализировать портфели российских компаний-производителей лекарств, то можно четко увидеть, что почти все компании строят свой бизнес на воспроизведенных препаратах, дженериках и биоаналогах. Исключение составляют буквально единицы — это несколько крупнейших производителей, но даже в этих случаях речь идет максимум о двух-трех по-настоящему инновационных проектах.
В результате свыше 90% всех существующих на российском рынке инновационных препаратов принадлежат зарубежным производителям.
Так сложилось исторически и с годами практически не менялось, и сейчас эта ситуация стала по-настоящему критичной. Зарубежные фармкомпании массово прекратили проведение клинических исследований в России, а это, в свою очередь, означает, что российские пациенты могут в ближайшие годы столкнуться с серьезными сложностями при доступе к наиболее современной и эффективной терапии.
Безусловно, можно разработать дженерик даже самого нового оригинального препарата. Но при таком подходе, нацеленном на копирование, все равно будет происходить существенное запаздывание в обеспечении российских пациентов. В любом случае, сначала надо 5-7 лет дожидаться регистрации препарата в FDA (Food and Drug Administration, США) и EMA (European Medicines Agency, страны Евросоюза) и вывода препарата на глобальный рынок, а затем ждать еще 2-3 года, когда станет возможным вывод на рынок его копии, даже при наличии процедуры принудительного лицензирования.

Таким образом, единственный способ сократить отставание и обеспечить полноценный лекарственный суверенитет — это развивать отечественную разработку оригинальных и инновационных препаратов.
2
От мишени до вывода
на рынок
Клинические испытания — наиболее сложная и затратная часть разработки новых лекарств. На нее уходит примерно 70% всей стоимости проекта от идеи и начальной гипотезы до вывода на рынок. Это справедливо как для инновационных, так и воспроизведенных препаратов. В классической парадигме разработки клинические испытания идут последовательно от первой фазы к третьей. И, если целью начальных фаз является изучение эффектов применения препарата на малых выборках здоровых добровольцев и пациентов, то на третьей фазе ключевой целью становится доказательство эффективности и достаточной безопасности применения потенциального лекарства на большой выборке испытуемых, максимально приближенной к реальной медицинской практике.
Процесс создания инновационных лекарств очень консервативный и практически не меняется десятилетиями. Сначала проводятся фундаментальные исследования определенных заболеваний, по итогам которых находят мишень — биологическую молекулу, при взаимодействии с которой можно добиться необходимых изменений в организме. Затем к процессу подключаются химики и молекулярные биологи для того, чтобы создать соединение, малую молекулу или биопрепарат, оптимальным образом взаимодействующее с мишенью. После этого начинается длительный процесс экспериментальных исследований, сначала in vitro, "в пробирке, а затем in vivo — на животных. Только после завершения всех трансляционных изысканий принимается решение о подготовке клинической программы исследований.
3
Создаются ли в России
оригинальные лекарства?
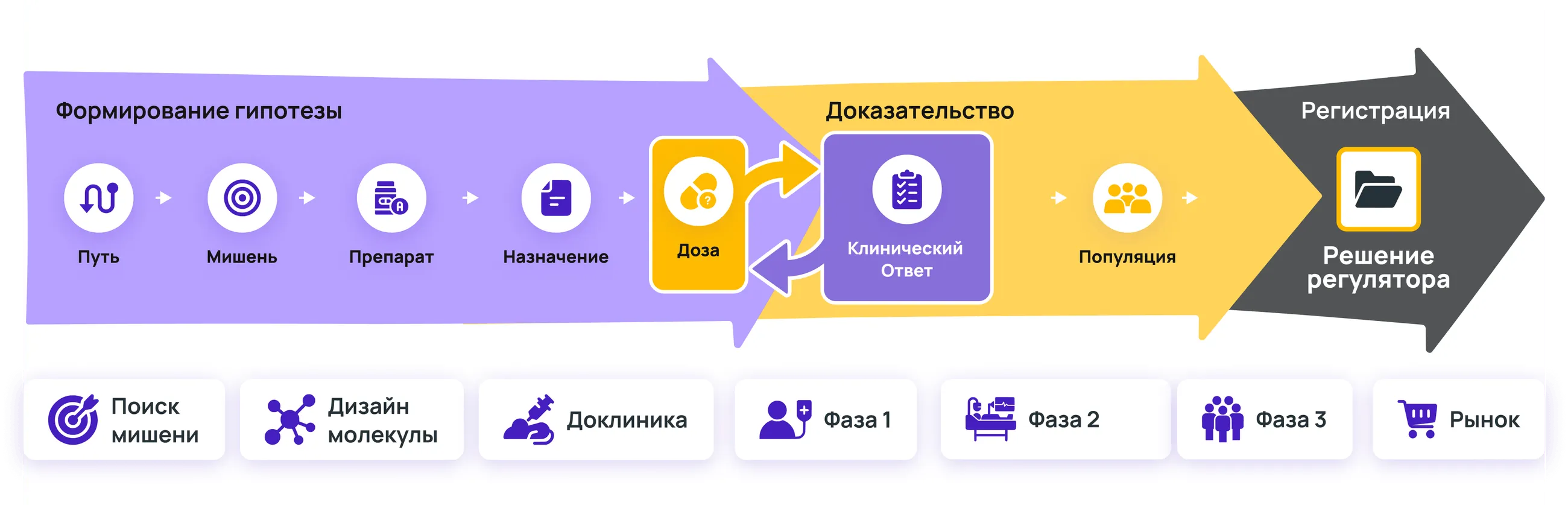
Длиться подобные исследования могут несколько лет, а бюджет достигать при этом нескольких сотен миллионов долларов. Только после положительных результатов доказательных исследований препарат может быть зарегистрирован регуляторными органами и стать доступным для пациентов.Издержки, связанные с проведением клинических исследований поздних фаз, напрямую влияют на цену инновационных препаратов при их выводе на рынок. При этом в стоимость препаратов, дошедших до пациентов, закладываются и траты на все неудачные проекты компании, ведь далеко не все разработки оказываются успешными. Стоит сказать, что общая продуктивность фармацевтической индустрии, остается по-прежнему очень низкой. Только 10% проектов, стартовавших в клинических испытаниях, успешно проходят всю программу разработки. Это во многом и определяет высокие цены на оригинальные препараты, которые, в свою очередь, существенно ограничивают их доступность для пациентов.
Высокая вероятность провала проектов и связанные с этим издержки приводят к тому, что российские фармкомпании чаще всего предпочитают не рисковать и продолжать заниматься тем, что они уже хорошо научились производить — дженерики и биоаналоги, что существенно ограничивает конкурентноспособность российских компаний и технологические возможности отечественной фарминдустрии.

Высокая вероятность провала проектов и связанные с этим издержки приводят к тому, что российские фармкомпании чаще всего предпочитают не рисковать и продолжать заниматься тем, что они уже хорошо научились производить — дженерики и биоаналоги, что существенно ограничивает конкурентноспособность российских компаний и технологические возможности отечественной фарминдустрии.
4
Не скрытые
возможности
Можно ли снизить количество провальных проектов и ускорить вывод на рынок действительно перспективных инновационных лекарств?Разработка лекарств — очень консервативная область, где ни в коем случае нельзя принимать поспешные решения и выводить на рынок препараты с недоказанной эффективностью или недостаточно изученной безопасностью. Слишком много страшных трагедий произошло по этим причинам. Тем не менее, в последние 30 лет научное сообщество предложило ряд способов, как адаптировать и улучшить существующую парадигму разработки лекарств.
Среди подобных инициатив можно отметить следующие:
- Совершенствование процедуры регулирования, например, за счет внедрения механизмов ускоренной регистрации или модификации требований к доказательной базе.
- Использование инновационных технологических платформ, таких как новые поколения таргетных биопрепаратов, генные терапии или лечение на основе генно-модифицированных клеток.
- Развитие инновационных подходов к дизайну клинических испытаний, поиск новых конечных точек, а также более информативных биомаркеров для комплементарной диагностики.
- Активное применение цифровых технологий на разных этапах разработки лекарств, в том числе для раннего прогноза потенциальных клинических эффектов и рационального планирования исследовательских программ.

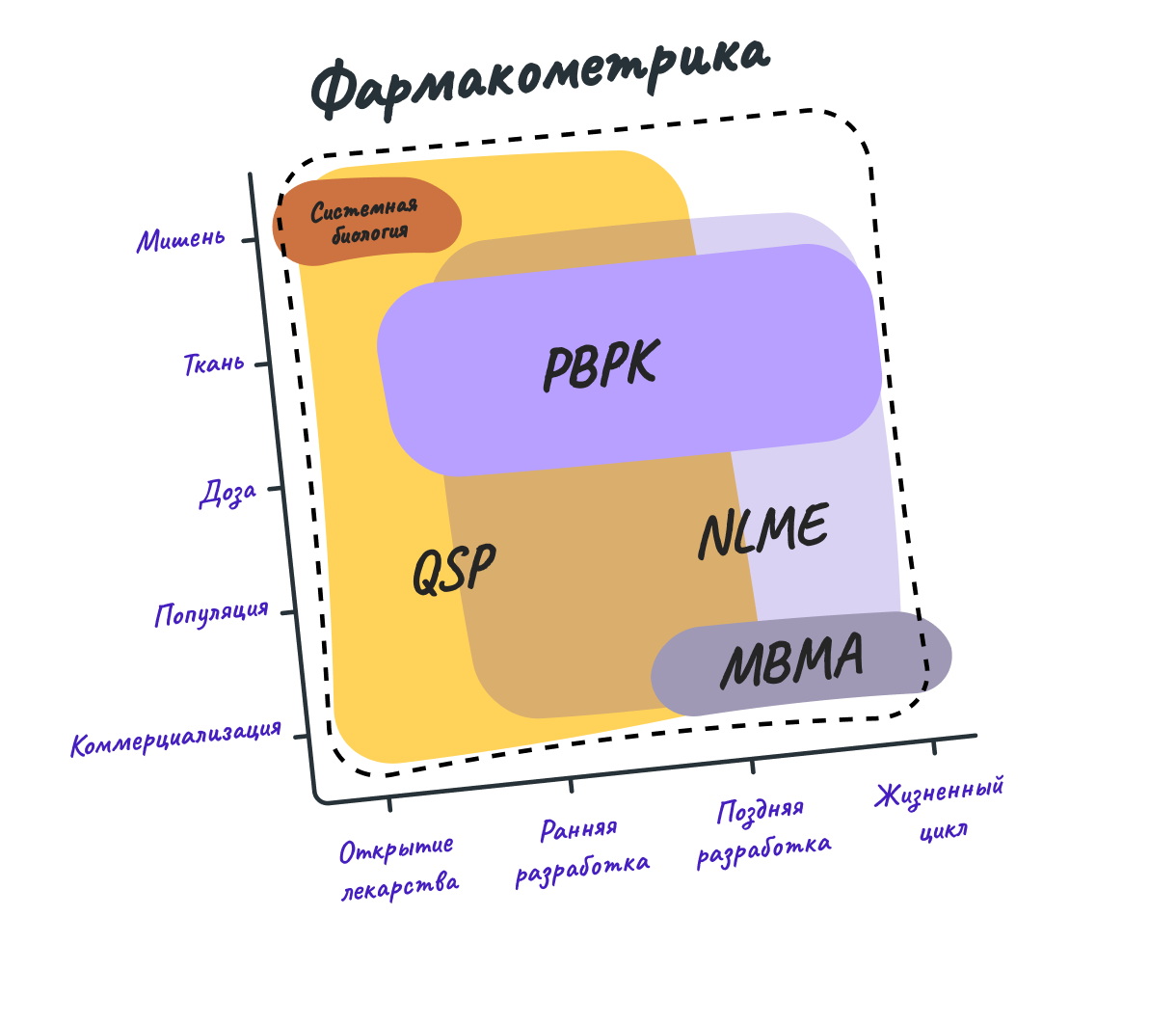
Именно для этого западными фармкомпаниями и регуляторными органами, FDA и EMA, активно применяются различные фармакометрические методы, как на основе математического моделирования, так и искусственного интеллекта.
Фармакометрические технологии можно применять на любой стадии создания лекарства. В том числе, на самых первых шагах, «тренируя» математическую модель действия препарата на максимальном количестве экспериментальных данных. Если разработчик модифицирует антитело или малую молекулу, о которой у специалистов уже есть историческая информация, моделирование позволяет просчитать, как эти изменения повлияют на фармакологические свойства, и даже спрогнозировать изменения в клиническом эффекте. Подобные модели можно применять и для виртуальных клинических испытаний действия препарата в узких группах пациентов, например, у больных с нарушенной работой почек или печени.
Стоит сказать, что математическое моделирование не может полностью заменить все реальные эксперименты, но тем не менее позволяет достоверно оценить эффект действия лекарства исходя из меньшего объема фактических данных. Главная цель математических моделей — предложить рациональный дизайн, т.е. сократить количество испытуемых в исследовании пациентов или оптимизировать способы анализа клинических конечных точек. Подобные адаптивные дизайны испытаний могут существенно сократить время и ресурсы, необходимые для их проведения без ущерба для доказательной силы. Это очень важно, потому что ошибки при планировании испытаний могут обойтись фармкомпании в сотни миллионов долларов убытков.


Это очень важно, потому что ошибки при планировании испытаний могут обойтись фармкомпании в сотни миллионов долларов убытков.
Высокая вероятность провала проектов и связанные с этим издержки приводят к тому, что российские фармкомпании чаще всего предпочитают не рисковать и продолжать заниматься тем, что они уже хорошо научились производить — дженерики и биоаналоги, что существенно ограничивает конкурентноспособность российских компаний и технологические возможности отечественной фарминдустрии.
5
Что поможет увеличить производство
инновационных лекарств?
Если обратиться к опыту США, как стране с наиболее развитой разработкой инновационных лекарственных средств, стоит отметить, что лидирующую роль в процессе трансформации фарминдустрии сыграл регулятор, FDA. Роль регулятора в США не ограничивается исключительно правовыми аспектами, но и напрямую касается научного внедрения новых технологий. Так, именно под эгидой FDA еще 20 лет назад был разработан ряд
рекомендаций по увеличению производительности фарминдустрии.
Эта инициатива оказалось очень эффективной и сейчас дает множество положительных результатов. Например, использование математического моделирования уже является полноценным регуляторным требованием.
Так, разработан целый ряд нормативных актов, не просто предусматривающий, а обязывающий использовать математическое моделирование при создании лекарств, как оригинальных, так и воспроизведенных. Кроме того, эта документация содержит ряд методологических указаний как правильно строить и применять математические модели, чтобы максимизировать выгоду от применения этого научного инструмента.

При этом сам диалог между регулятором и бизнесом достаточно хорошо отлажен: так, специалисты FDA могут официально принимать участие в консультировании фармкомпаний и биотехнологических стартапов, чтобы снизить вероятность ошибок разработчиков и напрямую предложить оптимальный способ вывода на рынок наиболее перспективных и нужных пациентам препаратов.
Российский регулятор тоже проделал большой путь по гармонизации регуляторных требований. Так, на уровне стран ЕАЭС было синхронизировано законодательство, касающееся разработки препаратов и проведения клинических испытаний. Эти документы максимально приближены к европейским и содержат ряд инновационных нововведений, что делает возможным для компаний-спонсоров использование математических моделей и других перспективных цифровых технологий для ускоренного вывода препаратов на рынок.
Примеры быстрого и коммерчески успешного, а главное научно-обоснованного вывода на рынок оригинальных лекарств в России есть — например, вакцина «Спутник V».
Она была разработана в кратчайшие сроки, после чего ее поставки удалось наладить в десятки стран мира.
Еще
один пример — создание российских инсулинов, на которые сейчас перешли российские пациенты с диабетом,
обезопасив себя от прекращения поставок из недружественных стран.
Необходимо в кратчайшие сроки
масштабировать подобные примеры, что потребует дальнейшего совершенствования регуляторной базы, развития
новых отечественных цифровых технологий разработки лекарств, а также активного диалога между регулятором
и
фармацевтическими компаниями. Реализация всех этих мер позволит российским фармкомпаниям эффективнее
вести
бизнес, а государству — обеспечить пациентов современной и качественной терапией без зависимости от
импорта.

Реализация всех этих мер позволит российским фармкомпаниям эффективнее вести бизнес, а государству — обеспечить пациентов современной и качественной терапией без зависимости от импорта.

